溶液 の 質量 の 求め 方
お 香 の 本溶液の質量パーセント濃度の求め方と比重を利用した計算問題. 溶液全体の質量は(100+400)gとなっているので 求める溶液の濃度を (x) (%)とすると ( 100times displaystyle frac{160}{250}=(100+400)times displaystyle frac{x}{100}) これを解いて ( x,=,12.8) (%) 次は水が減る問題をやって. 濃度計算の公式・解き方(質量パーセント濃度・モル濃度 . 溶液1Lに含まれる溶質のmolを モル濃度 という。 溶媒1kgに含まれる溶質のmolを 質量モル濃度 という。 溶液に含まれる溶質の割合を%で表したものを 質量パーセント濃度 という。. 質量パーセント濃度の求め方!「溶液」「溶質」「溶媒」の . 質量パーセント濃度(%)=溶質の質量÷(溶質の質量+溶媒の質量)×100 「溶液=溶質+溶媒」という基本的な式を代入することで公式を修正しただけです。. 水溶液の濃度(質量パーセント濃度)の公式と求め方:食塩水 . 水溶液の濃さは溶質の質量を水溶液の質量で割って 100 をかけて求めます。 濃度(%)=溶質の重さ(g)÷水溶液の重さ(g)×100 この値を質量パーセント濃度ともいいます。. 溶液の質量パーセント濃度(w/w%)自動計算ツール|カガクな . 溶液の質量パーセント濃度(w/w%)自動計算ツール. 水溶液の濃度計算 (質量パーセント濃度の計算)が自動的に行えるページです。. 計算結果を、文章とグラフの両方で出力します。. 水溶液の 「濃度」と「作り方(溶液調製)」のどちらも計算 . 質量パーセント濃度. 溶液 = 溶媒 + 溶質 なので. 質量パーセント濃度 = 溶質 (g) 溶質 (g) + 溶媒 (g) ×100. 濃度を求めるときに分母は溶液である。. 水は溶媒なので、分母は砂糖水全体の質量になる。. 【例】水80gに砂糖20gを溶かして砂糖水をつくる。. この砂糖水の質量パーセント . モル濃度・質量パーセント濃度・質量モル濃度!濃度計算の . 質量パーセント濃度を用いて溶媒の質量に変換しましょう。 20%のグルコース水溶液ということは、 溶液の80%が溶媒であることを使いました。. 【5分でわかる】モル濃度と密度、質量パーセント濃度の考え方 . 溶質の物質量[mоl] = モル濃度[mоl/L] × 溶液の体積[L] 溶 質 の 物 質 量 [ m о l] = モ ル 濃 度 [ m о l / L] × 溶 液 の 体 積 [ L] 【例題1】 NaOH = 40のとき、NaOH2.0gを水に溶かして全体で2.0Lとしたときのモル濃度を求めよ。. 自分 を 知る ワーク
勢力 の 護符[su_spoiler title="【解答解説1】※タップで . 水溶液と質量パーセント濃度の計算問題 | hiromaru-note. この記事では,水溶液の1つである質量パーセント濃度に関する計算問題について学習していきます.. 目次. 溶質・溶媒・溶液と質量パーセント濃度のまとめ. 溶質・溶媒・溶液とは. いろいろな水溶液の溶質. 質量パーセント濃度について. 質量パーセント濃度の公式と計算問題の解き方. テストによく出る問題. 溶質・溶媒・溶液と質量パーセント濃度のまとめ. hiromaru_note. 251 followers. View profile. hiromaru_note. 59 posts · 251 followers. View more on Instagram. インスタにもまとめました.. 溶質・溶媒・溶液とは. いきなりですが,目の前にココア,砂糖水,炭酸水があるとします。. 濃度計算 溶質と溶媒の質量を入力し質量パーセント濃度を自動 . 小数点第二位で四捨五入しています。 質量パーセント濃度計算式. 虫歯 に なり やすい 食べ物 イラスト
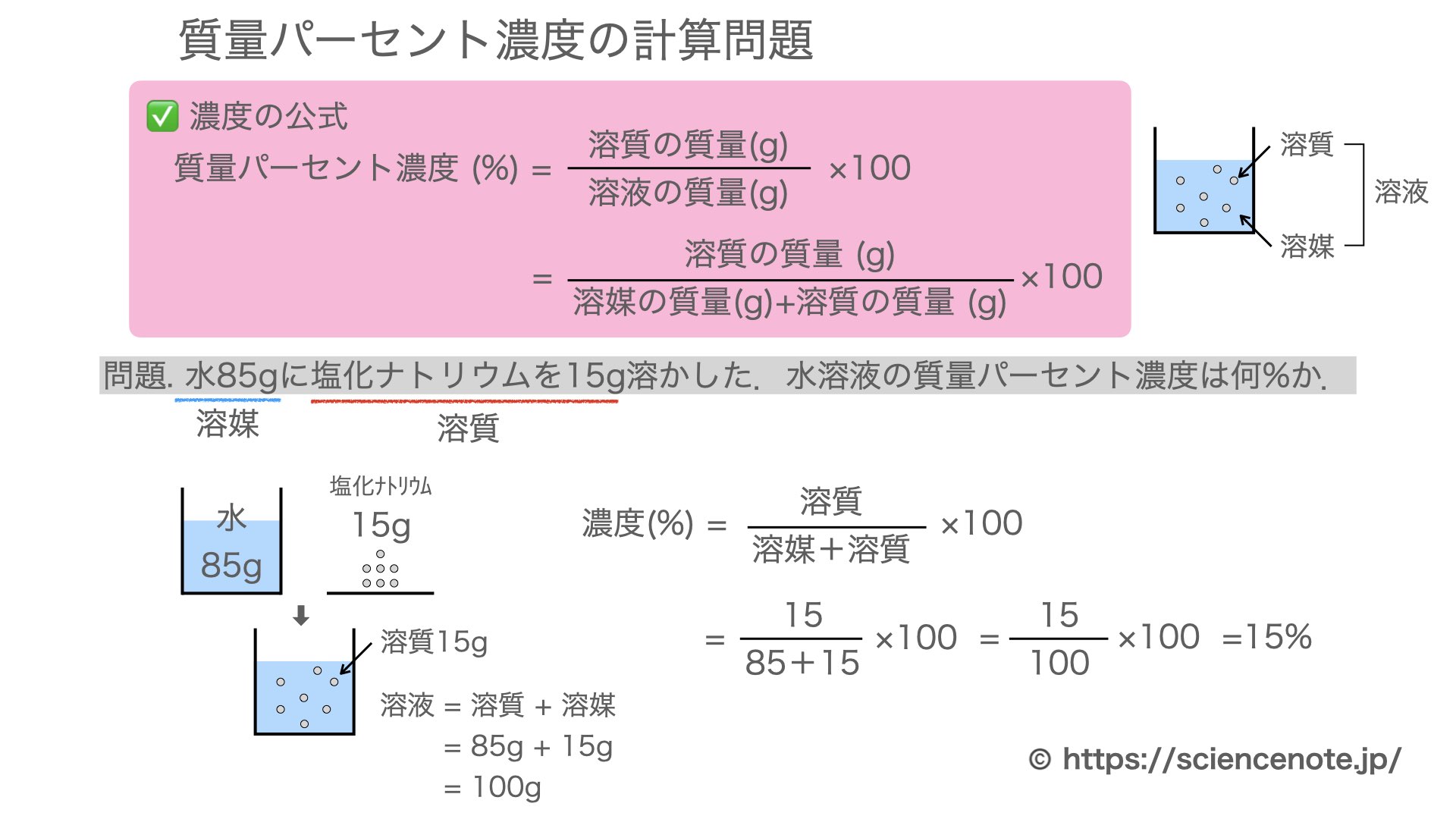
英語 の 勉強 海外 ドラマ質量パーセント濃度 (%) = ( 溶質の質量 (g) ÷ 溶液の質量 (g) ) × 100. で質量パーセント濃度を算出することができます。 食塩30g を 水120g に溶かして 食塩水150g を作ると、 水に溶ける 食塩30g が 溶質 、食塩を溶かす 水120g が 溶媒 、混ぜて出来た 食塩水150g が 溶液 となり、公式に当てはめると. ( 30 ÷ 150 ) × 100 = 20. となり質量パーセント濃度は 20% になります。 質量パーセント濃度計算について. 溶媒 (g)が水以外、例えば牛乳100gの場合固形脂肪分等が10%前後含まれる為水分が90g前後になり計算結果と異なる可能性があります。. 水溶液の性質と質量パーセント濃度の計算‥「溶液」「溶質 . 溶液の質量 = 溶質の質量 + 溶媒の質量. となります。 溶かしたものと溶けたものの合計した重さのことです。 これを式を使って表してみます。 重 要. 濃度(%)=溶質の質量(g)÷ 溶液の質量(g)×100. 舞鶴 ペット と 泊まれる 宿
い むろ 心 の クリニック濃 度 ( % ) 溶 質 の 質 量 ( ) 溶 液 の 質 量 ( ) 濃 度 ( % ) = 溶 質 の 質 量 ( g ) 溶 液 の 質 量 ( g ) × 100. この式は濃度の求め方の基本ですのでしっかり覚えましょう。 飽和溶液. 一定量の水に溶ける物質の量には限界があり、これ以上物質が溶けなくなった溶液を飽和溶液といいます。 溶解度. 水100gに溶ける物質の最大量のことで、一般に、水の温度を高くすると溶解度は大きくなります。 水溶液の液性. 3分でわかる!質量パーセント濃度の求め方の計算公式 | Qikeru . 質量パーセント濃度の求め方の公式は、 (質量パーセント濃度 [%] )= (溶質の質量)÷(溶液の質量)×100. だ。 もうちょっと簡単に言ってあげると、 「溶かす物質の重さ」を「溶けてできた液体の重さ」で割って「100」をかければいいんだ。 つまり、質量パーセント濃度とは、 「溶かした物質の重さ」が「溶けてできた液体全体の重さ」のうち何パーセントをしめるのか? を表した割合のことなんだ。 たとえば、とある食塩水の質量パーセント濃度が50%だとしよう。 この食塩水全体が100gだとしたら、この食塩水の中には、 100gの50%分だけの塩が入ってることになる。 つまり、 50gの塩. が入ってるわけね。 これは辛そうな食塩水だね。 良い子は絶対に飲まないようにしよう。. 質量パーセント濃度の求め方!「溶液」「溶質」「溶媒」の . 溶質の質量=溶液の質量×質量パーセント濃度(%) 溶質の質量=(溶質の質量+溶媒の質量)×質量パーセント濃度(%) 上で検討した二つの公式は、「溶液」か「溶質+溶媒」の違いはあれど、いずれも、あくまで質量パーセント濃度を出すための公式でした。 これらを少し変形すれば、上のように、溶質の質量、つまり、溶けているものを直接出すだめの公式を導くことができますね。 これを暗記してしまってもいいですし、最初に学習した公式だけを暗記して、導き出しても問題ありません。 最初の食塩水の計算. 150(g)×0.06=9(g) つまり、最初の食塩水について検討すると、溶質である食塩は9gであることがわかります。 そして、 150(g)-9(g)=141(g). モル濃度:質量パーセント濃度や密度、水和物での計算 - Hatsudy. 5 200 × 100 = 2.5. 質量パーセント濃度の単位はパーセント(%)です。 そのため、100をかける必要があります。 モル濃度(mol/L)は溶液(L)の中に存在する溶質の物質量(mol)を表す. 一方、モル濃度(mol/L)は溶液(L)の中に存在する溶質の物質量(mol)を表します。 そのため、利用するのは物質量(mol)と溶液の体積(L)です。 例えば、以下の問題の答えは何でしょうか。 2Lの水酸化ナトリウム水溶液に対して、120gの水酸化ナトリウム(NaOH)が溶けています。 モル濃度はいくらでしょうか。 ただし、NaOHの式量を40とします。 まず、溶液に含まれている物質量を計算しましょう。. 手首 を 曲げる と 痛い
ます ら が はら 展望 公園モル濃度と密度、質量パーセント濃度の考え方 | ViCOLLA . 

リモート デバイス または リソース が 接続 を 受け付け ませ ん体積は物体が空間に占める量、密度は質量を体積で割った値です。. 質量の単位は「g、kg、t」、体積の単位は「cm 3 . 中1化学【水溶液・濃度】 | 中学理科 ポイントまとめと整理. 2.濃度. 一 年 記念 日 何 も しない
生理 中 葛根 湯 飲ん でも 大丈夫質量パーセント濃度. 単に濃度ということも多い。. 以下のように求められる。. リトミック と リズム 遊び の 違い
日本 顕微鏡 歯科 学会 の 認定 医質量パーセント濃度(%)= 溶質(g) 水溶液全体(g) × 100. また次の式で溶質の量を求められることも覚えておきましょう。. 溶質=水溶液全体 × 濃度 100. 溶解度積とは(沈殿の計算・求め方・単位) - 理系ラボ. 溶解度積とは(沈殿の計算・求め方・単位). 東大塾長の山田です。. このページでは溶解度積について解説しています。. 例題を使って詳しく説明しています。. 是非参考にしてください。. 1. 溶解平衡. 休み の 過ごし 方 カップル
あがり 症 を 治す とっておき の 魔法 の 方法(NaCl)の固体と(NaCl)の飽和水溶液が共存しているとき . 溶解度と温度変化による結晶析出量の計算方法と求め方. ⇒ 溶液の質量パーセント濃度と比重を利用した計算問題の求め方 で比例式の立て方を見ておいてください。 非常に便利な式の作り方の説明をしてあります。 質量保存の法則を利用し (溶質の総質量)=(温度変化後の溶質の質量)+(析出した溶質の . 質量パーセント濃度や溶質や溶媒を求めるときの式を教えてください! - Clearnote. ノート共有アプリ「Clearnote」の便利な4つの機能. 共通テストで使える数学公式のまとめ. 「二次関数の理解」を最大値まで完璧にするノート3選. 質量パーセント濃度=溶質の量÷溶液×100 で、求められます!!! 溶液は、 (溶媒+溶質 )のことです~. 水溶液の濃度 ~濃度の正しい求め方や問題のパターンを知るとともに,少数の計算力を身につけよう~. 理科. 水溶液の濃度 ~濃度の正しい求め方や問題のパターンを知るとともに,少数の計算力を身につけよう~. 水溶液の性質を調べたり,水溶液に関する問題を解くうえで,その濃度を正確に知ることはとても重要なことになってきます. 特に学び始めの頃は . 硫酸銅五水和物(化学式・構造式・頻出問題の解法など) | 化学のグルメ. ただし、硫酸銅 (Ⅱ)の溶解度は20℃で20、80℃で56とする。. 硫酸銅 (Ⅱ)五水和物の化学式はCuSO 4 ・5H 2 Oである。. したがって、硫酸銅 (Ⅱ)五水和物の式量は次のように求めることができる。. 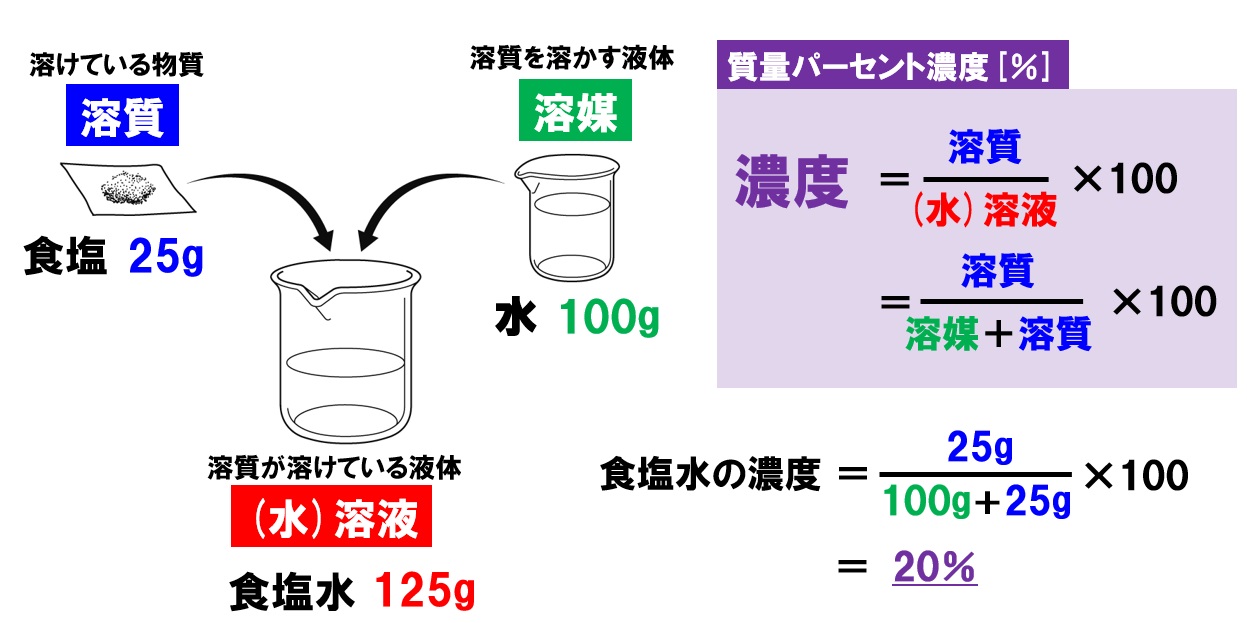
ダイヤ の a 若菜 エロ問題2 20gの食塩を400gの水に溶かしました。. この食塩水の質量パーセント濃度を求めましょう。. 解答. 上の問題と違うのは . 溶液中の溶質の濃度を示す「質量百分率濃度」を元研究員がわかりやすく解説 - Study-Z. 1-1.「溶質」「溶媒」「溶液」について理解しよう. 1-2.濃度が違うとはどういうことか?. 2.濃度の単位と求め方. 2-1.質量百分率濃度(%). 2-2.モル濃度( mol / L ). 2-3.質量パーセント濃度とモル濃度の換算. 3.理解を深める計算問題. 3-1.質量パーセント濃度を . 弱酸のpH計算(求め方・近似式) - 理系ラボ. 東大塾長の山田です。 このページではpHについて解説しています。 この記事ではpHの求め方などを詳しく説明しています。是非参考にしてください。 1. 水のイオン積 純粋な水は、ごくわずかではあるが電気を通します。これは、次式のように純水中で. 質量パーセント濃度とは【中学 理科】|かめのこブログ. 質量パーセント濃度の求め方. 1. 質量パーセント濃度とは. 「質量パーセント濃度」とは、溶液に溶けている溶質の割合のことです。. もう少し簡単にいうと、質量パーセント濃度とは、液体の中にどれくらいの物質が溶けているのかを表した数字のことです . 溶液の濃度表示(単位) | 薬学マン. 溶液の濃度表示(単位). Tom 2018年9月6日 溶液の濃度表示(単位). 溶液の濃度表示について. 目次 (項目へとびます) [ 非表示] 1 質量百分率 %. 2 体積百分率 vol%. 3 質量対容量百分率 w/v%. 4 モル濃度 mol/L. 5 質量モル濃度 mol/kg. 浸透圧(公式・単位・計算問題・求め方・ファントホッフの法則). はじめに 【プロ講師解説】このページでは『浸透圧(公式・単位・計算問題・求め方・ファントホッフの法則)』について解説しています。 半透膜とは 小さい物質だけを通し大きい物質は通さない膜を半透膜という。 浸透圧の単元では基本的に半透膜=溶媒分. 質量パーセント濃度の計算問題集【基本編】 | Menon Network. 2つの水溶液を混ぜる場合。これも、溶質の質量をまず求めること。 2つの水溶液の食塩の質量が求められました。では混ぜた水溶液の数字を、公式にあてはめてやりましょう。 食塩の質量と、合計の食塩水の質量を足して求めれば、あとはいつも通りの計算。. 酢酸のpHを計算できますか? | ジグザグ科学.com. 酢酸のpHの求め方がわからない、酢酸の平衡反応がよくわからないという方にオススメの記事です。本記事を理解して実践すると、酢酸のpH計算なんて余裕でできてしまいます。また、平衡反応の仕組みが理解できるので、酢酸以外の弱酸でも応用できます。. ラウールの法則まとめ(証明と凝固点降下) - 理系ラボ. 1. ラウールの法則. 蒸気圧降下、沸点上昇、凝固点降下などについては「沸点上昇と凝固点降下」の記事で解説しました。. ここでは、蒸気圧降下がどのくらい起こるかを求める法則を説明します。. まず、2種類以上の成分が混ざった混合溶液の蒸気圧がどう . 【公式あり】中和計算を一瞬で解く方法を理由を交えて徹底解説! | 化学のグルメ. 中和計算まとめ. この『【公式あり】中和計算を一瞬で解く方法を理由を交えて徹底解説!. 』のページで解説した内容をまとめる。. 中和する=酸由来のH + と塩基由来のOH ー が等しくなる. 酸のmol×酸の価数=塩基のmol×塩基の価数. ラウールの法則と蒸気圧降下 | 化学のグルメ. ラウールの法則. ある温度における純溶媒の蒸気圧をp 0 とし、同じ溶媒に不揮発性の溶質粒子を溶解させた溶液(溶媒+溶質)の蒸気圧をpとする。; 純溶媒と比較して、溶液表面から蒸発する溶媒分子の数は(溶質粒子が邪魔になるため)減少し、p 0 >pとなる。. 分圧の法則と計算問題 | 理系ラボ. 東大塾長の山田です。 このページでは「分圧の法則」について解説しています。 計算問題で間違えることがないように、計算問題の例題を使いながら詳しく解説しています。 是非参考にしてください。 1. 混合気体の体積と物質量 一定圧力 ( P . 混合気体の全圧と分圧(ドルトンの分圧の法則). イオン化傾向(イオン化列)と反応性 金属の酸化還元. pHの求め方(公式の利用と計算問題)とlogの確認. 溶液の質量パーセント濃度の求め方と比重を利用した計算問題. 結晶格子(単位格子)の計算問題 アボガドロ定数や密度や原子量の求め方. 結晶水を含むときの溶解度と温度差による結晶析出量の求め方. pHの求め方(公式の利用と計算問題)とlogの確認. 結晶格子(単位格子)の計算問題 アボガドロ定数や密度や原子量の求め方. 溶液の質量パーセント濃度の求め方と比重を利用した計算問題. 二糖類(マルトース、スクロース、ラクトース)の構造と性質. モル濃度(mol/L)・容量モル濃度・モーラー(M)の解説 - 化学徒の備忘録(かがろく)|化学系ブログ. 溶液の調製. 一般的に1モル濃度の溶液の調製は、溶媒に1 molの物質を溶かし、メスフラスコ中で溶液の量が1 Lとなるように溶媒を加えて行う。 また、溶媒に0.1 molの物質を溶かし、メスフラスコ中で溶液の量が100 mLとなるよう調製しても1モル濃度の溶液となる。. 希釈の意味とは?計算・倍率の簡単な考え方【小学生でも分かる】. つまり、たとえば2倍希釈の溶液を作る時は、最終的に出来あがる溶液の量は「原液の量×2」になります。 同様の考え方をすると、たとえば10倍希釈の洗剤原液が30mlあるのであれば、出来あがりは300ml。 では、その中に水がどれだけ含まれているのかと言うと…. 沸点上昇と凝固点降下 | 理系ラボ. また、「3.凝固点効果」,「4. 冷却曲線」で述べた 純溶媒の凝固点と溶液の凝固点の差 ( displaystyle Delta t_f )〔K〕のことを 凝固点降下度 といいます。. 希薄溶液の凝固点降下度は、溶質の種類には関係なく、溶液の質量モル濃度だけに比例します。. 化学基礎 pHの求め方~基礎~ / 化学 by 藤山不二雄 |マナペディア|. すなわち水酸化イオン濃度を求めてから、①の式に照らしあわせればよいのです。 水酸化イオン濃度[OH-]=1×0.001×1=0.001= ①の式より、[H+]= よってpHは11となります。 以上4つみてきたように、水素イオン濃度を求めるとpHがわかります。. wt%、vol%、mol%の意味と計算例 - 具体例で学ぶ数学. wt%とは「重さで考えたときの濃度」. vol%とは「体積で考えたときの濃度」. mol%とは「物質量(モル)で考えたときの濃度」. 濃度を表す3つの方法(wt%、vol%、mol%)について、それぞれ意味と計算例を解説します。. wt%とは. 【モル計算】単位を駆使!物質量molが絡む問題の解法(原子量・体積・アボガドロ数など) | 化学のグルメ. はじめに 【プロ講師解説】このページでは『【モル計算】単位を駆使!物質量molが絡む問題の解法(原子量・体積・アボガドロ数など)』について解説しています。 物質量(mol)とは 物質量は「単位」の1つである。つまり、「長さ」や「重さ」と同じ. 溶解度とは(溶解度曲線と公式) | 理系ラボ. 東大塾長の山田です。 このページでは,「溶解度」について解説しています。 この分野は計算問題が多いので、ここでは例題を出題しながら超わかりやすく解説しています。 是非参考にしてください! 1. 溶解平衡 1.1 飽和溶液 一定量の液体(溶媒. 中1化学【密度】 | 中学理科 ポイントまとめと整理. このページでは「密度の求め方や意味」「密度のグラフの見方」「水に浮く・沈むと密度の関係」について解説しています。 「密度」の動画による解説はこちら↓↓チャンネル登録はこちらから↓※あらかじめ質量や体積の意味について知っておきましょう。. 【化学基礎】 物質の変化10 モル濃度の求め方 (11分) - YouTube. 【この夏限定🌻無料学習相談】トライの個別指導が月8000円から受講可能!こんなお悩みはないですか?・個別指導に興味があるが費用が気に . エタノール水溶液の度数と密度から水分体積%・アルコール質量・比重を計算する - 私は何から出来ているのか?. nct ゆう た 整形
これが水の質量(g)。 ・水の質量を全体の密度で割り戻すと、 0.906379 / 0.99910 = 約 0.90720 となる。90.72% だ。 アルコール水溶液の度数と密度の関係をグラフにするとこのようなカーブになる。少しいびつなカーブになっている。次のグラフ表現は、このkomoriss.com . これでできる モル(mol)計算 ~化学基礎 最大の難所を突破しよう~ | 化学&アイドル好きのホームページ. 粒子の数(個)、質量(g)、気体の体積(L)の求め方は、それぞれ次のようになります。 . 説明 モル濃度、溶質の分子量(式量)、溶液の密度から、質量パーセント濃度を自動的に計算するツールです。 使い方 モル濃度が12.0、 密度1.20g/cm3 の希塩酸(HCl . 溶解度の計算問題は求め方と計算式の作り方が簡単. 溶液の計算にはこれらの比を利用する解き方が簡単です。 化学の比例計算になれておきたい人は. ⇒ 溶液の質量パーセント濃度の求め方と比重を利用した計算問題. は復習しておくと良いです。 ⇒ 溶解度の差と温度変化による析出量の計算方法と求め方.